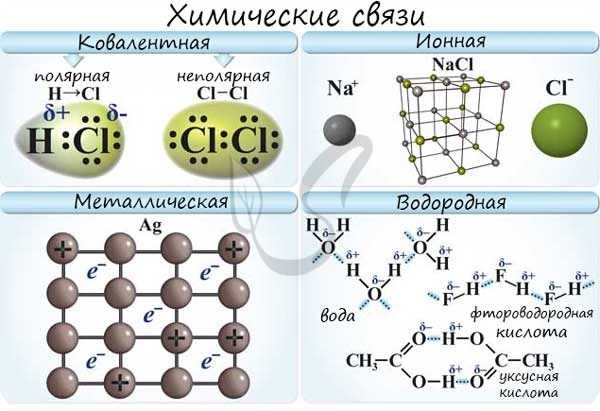
Химическая связь — это важная концепция в химии, которая описывает способ, которым атомы и молекулы связаны друг с другом. Существуют различные типы химической связи, включая ионные, ковалентные и металлические связи.
Ионная связь возникает между атомами, которые имеют разную электроотрицательность. Один атом становится положительно заряженным ионом (катионом), а другой атом становится отрицательно заряженным ионом (анионом). Притяжение этих противоположно заряженных ионов создает ионную связь.
Ковалентная связь возникает, когда два атома сопредельных элементов делят одну или несколько пар электронов. Эта связь является наиболее распространенным типом связи в органической и неорганической химии. Ковалентная связь может быть полярной или неполярной, в зависимости от разности электроотрицательности атомов.
Металлическая связь образуется между металлическими элементами и является основной причиной характерных свойств металлов, таких как электропроводность и теплопроводность. В металлической связи атомы металла образуют решетку кристаллической структуры, в которой свободные электроны могут свободно двигаться между атомами.
Ионная связь: свойства и примеры
- Притяжение между ионами с разными зарядами
- Образование кристаллической структуры
- Кристаллические соединения обладают высоким точками плавления и кипения
- Растворимость ионных соединений в воде
- Хорошая электропроводность ионных соединений в растворе или плавленом состоянии
Примеры ионных соединений:
- Хлорид натрия (NaCl) — обычная поваренная соль
- Оксид магния (MgO) — основной компонент магнезита и доломита
- Хлорид калия (KCl) — используется в пищевой промышленности и медицине
- Сульфат меди (CuSO4) — применяется в медицине и живописи
- Фосфат кальция (Ca3(PO4)2) — основной компонент костей и зубов
Ионные связи играют важную роль в химии и имеют широкие применения в различных отраслях науки и технологии.
Ковалентная связь: особенности и примеры
- Общее использование электронов. Атомы в ковалентной связи обменивают электроны, чтобы достичь стабильной электронной конфигурации.
- Образование молекул. Ковалентная связь приводит к образованию молекул, состоящих из атомов, связанных друг с другом.
- Силы ковалентной связи. Ковалентная связь обычно является крепкой и требует энергии для разрыва.
- Способы образования. Ковалентные связи могут образовываться между атомами одного и разных элементов.
Примеры ковалентной связи включают связь между двумя атомами водорода (H2), также известную как молекулярный водород. Оба атома водорода делят свои электроны, образуя ковалентную связь.
Другим примером является связь в молекуле метана (CH4), где четыре атома водорода образуют ковалентные связи с атомом углерода.
Заключение
Ковалентная связь является важным типом химической связи и играет роль в образовании молекул различных соединений. Она характеризуется общим использованием электронов атомами, образованием крепких связей и способностью образовываться между атомами одного и разных элементов.
Металлическая связь: характеристики и примеры
Основные характеристики металлической связи:
- Проводимость электричества и тепла: благодаря наличию свободных электронов, металлы обладают высокой электрической и тепловой проводимостью. Это объясняет их способность проводить электрический ток и передавать тепло.
- Пластичность и деформируемость: металлы обладают способностью изменять форму без разрушения связей между атомами благодаря подвижности электронов проводимости.
- Металлический блеск: свободные электроны в металлах способны поглощать и переизлучать энергию в видимом спектре, что придает металлам характерный блеск.
- Реактивность: металлы имеют тенденцию образовывать ионы положительной заряды, проявляющуюся в их реакциях с кислотами и другими реагентами.
Примеры металлической связи:
- Алюминий: в кристаллической структуре алюминия атомы алюминия образуют кубическую решетку, внутри которой находятся свободные электроны проводимости.
- Железо: в кристаллической решетке железа атомы железа образуют гранцентрированную кубическую структуру, а свободные электроны проводимости перемещаются между атомами и послуживают основой для металлической связи.
- Медь: медь образует кубическую решетку, и свободные электроны проводимости перемещаются между атомами меди.
Дипольно-дипольное взаимодействие: проявление и примеры
Дипольно-дипольное взаимодействие возникает при взаимодействии полярных молекул. Одна молекула с положительно заряженной областью притягивает отрицательно заряженную область другой молекулы и наоборот. В результате этих притяжений возникают силы взаимодействия, которые придерживают молекулы друг к другу.
Примеры дипольно-дипольного взаимодействия:
1. Молекулы воды (H2O) обладают полярными связями. Кислородный атом частично отрицательно заряжен, а водородные атомы – частично положительно заряжены. В результате положительно заряженный водородный атом одной молекулы притягивает отрицательно заряженный кислородный атом другой молекулы, и наоборот. Это взаимодействие позволяет молекулам воды образовывать водородные связи.
2. Молекулы аммиака (NH3) также образуют дипольно-дипольные взаимодействия. Азотный атом в аммиаке содержит одну несвязанную пару электронов. Она создает отрицательно заряженное облако вокруг азотного атома, позволяя аммиаку образовывать взаимодействия с полярными молекулами.
Водородная связь: свойства и примеры
Основные свойства водородной связи:
- Водородная связь происходит между атомом водорода и электроотрицательным атомом другого элемента, таким как кислород, азот, фтор.
- Водородная связь является слабой, поэтому она обычно имеет энергию примерно от 5 до 30 кДж/моль. Однако, в совокупности, водородные связи могут обеспечивать значительную стабильность молекуле или кристаллической решетке.
- Водородная связь обладает направленностью и сильной полярностью. Это означает, что атомы, участвующие в водородной связи, имеют частичные положительный и отрицательный заряды, что приводит к образованию электростатического притяжения.
- Водородная связь влияет на многие химические и физические свойства веществ. Например, водородная связь между молекулами воды обеспечивает ее высокую теплоту испарения и поверхностное натяжение.
Примеры водородной связи включают:
| Вещество | Примеры водородной связи |
|---|---|
| Вода | Молекулы воды взаимодействуют через водородные связи, образуя жидкость с высокой теплотой испарения. |
| ДНК | Нити ДНК удерживаются вместе благодаря водородным связям между азотистыми основаниями. |
| Белки | Водородные связи играют ключевую роль в пространственной структуре белков, обеспечивая их устойчивость и активность. |
Водородная связь является важным фактором во многих химических и биологических процессах. Понимание ее свойств и примеров позволяет лучше понять поведение веществ и различные аспекты их функционирования в природе.
Ван-дер-ваальсово взаимодействие: проявление и примеры
Суть ван-дер-ваальсового взаимодействия заключается в том, что дипольные моменты, возникающие в нейтральных или асимметричных молекулах, притягивают друг друга, вызывая слабое притяжение между ними. Данное взаимодействие участвует в формировании различных структур, таких как молекулярные кристаллы и жидкости, а также влияет на свойства веществ.
Проявление ван-дер-ваальсового взаимодействия:
1. Парафиновое вещество образует кристаллическую решетку из-за слабого взаимодействия молекул ван-дер-ваальсовыми силами.
2. Газы имеют низкую температуру кипения и плавления из-за слабого взаимодействия молекул ван-дер-ваальсовыми силами.
3. Жидкости имеют низкую вязкость из-за слабого взаимодействия молекул ван-дер-ваальсовыми силами.
Примеры ван-дер-ваальсового взаимодействия:
1. Молекулы водорода притягиваются друг к другу силами ван-дер-ваальсового взаимодействия.
2. Молекулы метана образуют слабые связи ван-дер-ваальсовыми силами.
3. Молекулы йода образуют слабые связи ван-дер-ваальсовыми силами.
Ван-дер-ваальсово взаимодействие является важным фактором при объяснении химических свойств и поведения молекул и веществ. Оно играет существенную роль в многочисленных процессах в природе и технологии.
Дисульфидная связь: характеристики и примеры
Дисульфидные связи являются очень сильными и стойкими. Они обладают высокой энергией, что делает их трудно разрушаемыми. В природе дисульфидные связи встречаются в различных органических соединениях, особенно в белках. Дисульфидные связи играют важную роль в структуре и функционировании белков и способны обеспечивать их устойчивость и формирование определенных структур.
Примером белка, который содержит дисульфидные связи, может служить кератин, который является основным компонентом волос и ногтей. Дисульфидные связи в кератине придают прочность и эластичность этим тканям.
Другим примером соединения с дисульфидной связью являются глутатион и тиреопероксидаза. Глутатион является мощным антиоксидантом и выполняет защитную функцию в клетке. Тиреопероксидаза, находящаяся в щитовидной железе, играет ключевую роль в синтезе гормонов щитовидной железы.
Таким образом, дисульфидная связь является важным типом химической связи, который играет значимую роль в биологических процессах и поддержании стабильности различных соединений.
Координационная связь: особенности и примеры
Координационная связь образуется, когда лиганды передают свои незаполненные электронные оболочки на незаполненные места на внешней оболочке центрального атома. Это создает ковалентные связи между центральным атомом и лигандом, образуя комплекс. Центральный атом координационного комплекса становится положительно заряженным и называется центральным катионом, а лиганды становятся отрицательно заряженными и называются комплексантами.
Примеры координационной связи:
1. Образование комплекса между железом (Fe) и карбонилом (CO):
Fe + 5CO > Fe(CO)5
2. Образование комплекса между медью (Cu) и аммиаком (NH3):
2Cu + 4NH3 > [Cu(NH3)4]2+
3. Образование комплекса между железом (Fe) и цианидом (CN):
Fe + 4CN > [Fe(CN)4]2-
Координационная связь имеет важное значение во многих процессах, таких как катализ, молекулярное распознавание и химические реакции. Более того, она играет роль в биологических системах, таких как ферменты и витамины.
Ковалентная связь в безорганических соединениях: свойства и примеры
Свойства ковалентной связи:
- Образуются между неметаллическими элементами;
- Возникают при совместном использовании электронов внешней оболочки атомов;
- Образуются за счет обмена электронами;
- Являются довольно сильными связями;
- Могут образовывать одинарные, двойные и тройные связи, в зависимости от количества обмениваемых электронов между атомами.
Примеры безорганических соединений с ковалентной связью:
1. Диоксид кремния (SiO2) – вещество, образующее кристаллическую сетку из кремниевых и кислородных атомов. Ковалентные связи между ними обеспечивают прочность и твердость диоксида кремния.
2. Диоксид углерода (CO2) – газообразное вещество, образованное связью между одним атомом углерода и двумя атомами кислорода. Ковалентные связи делают CO2 устойчивым и позволяют ему быть главным компонентом атмосферы Земли.
3. Аммиак (NH3) – газообразное соединение, содержащее атом азота и три атома водорода. Ковалентные связи между атомами создают стабильную молекулярную структуру аммиака.
Ковалентная связь в безорганических соединениях является ключевым элементом их структуры и свойств. Она определяет химическую устойчивость соединений и их способность взаимодействовать с другими веществами.
Ковалентная связь в органических соединениях: характеристики и примеры
1. Силы и стабильность связи
Ковалентная связь является одной из наиболее сильных форм химической связи. Благодаря совместному использованию электронов от двух атомов, образуется энергетически выгодное состояние, обеспечивающее стабильность молекулы.
2. Способность образовывать множество соединений
Ковалентная связь позволяет атомам образовывать большое количество различных молекул. За счет возможности изменять число и тип связей, органические соединения обладают огромным разнообразием.
3. Обмен электронами
В ковалентных соединениях электроны перемещаются между атомами, образуя общие пары (covalent bonds). Это позволяет атомам достигать заполнения своих валентных оболочек и образовывать устойчивые молекулы.
Примеры органических соединений с ковалентной связью:
- Метан (CH4) – основной представитель углеводородов, состоящих из атомов углерода и водорода.
- Ацетон (C3H6O) – растворитель, используемый в лакокрасочной промышленности.
- Этанол (C2H5OH) – спирт, широко используемый в медицине и пищевой промышленности.
- Бензол (C6H6) – ароматическое соединение, используемое в производстве пластмасс и лекарств.
Ковалентная связь в органических соединениях обеспечивает их структурную целостность и свойства, определяющие их функциональные возможности и функциональность. Понимание ковалентной связи важно для изучения органической химии и разработки новых соединений в научных и промышленных целях.